1. Úvod: kdo je endoterm, kdo tachymetabolik a proč na tom záleží
Jednou z mnoha otázek, která přestane dávat smysl po přijetí dinosauří příslušnosti ptáků, je ta na dinosauří endotermii. Většina známých dinosaurů samozřejmě endotermní je, můžeme se ptát akorát na to, zda byli endotermní úplně všichni. Také oblíbená otázka, zda dinosauři byli "ektotermní podobně jako dnešní plazi", nebo spíš "endotermní jako žijící savci a ptáci", vůbec nedává smysl. Vyvolává mylný dojem, že žijící amnioty můžeme jednoznačně roztřídit do dvou jasně vymezených fyziologických kategorií, jejichž vnitřní rozdíly zcela ignoruje – ačkoli mohou být právě tak velké, jako rozdíly mezi kategoriemi samými. Většině těch, kteří tuto otázku kladou, navíc vůbec nejde o endotermii jako takovou: až příliš často se míchají dohromady pojmy, které spolu vlastně téměř nesouvisí. Endotermie znamená jen to, že zvíře své teplo získává z vnitřních tělesných procesů a ne z okolního prostředí; tuto podmínku ovšem splňuje i kožatka velká, tuňáci, lamnovití žraloci nebo mečouni, nad nimiž se nikdo příliš nedojímá. Pro rychlý a aktivní způsob života, který je v celé debatě akcentován, je totiž daleko podstatnější metabolická rychlost než zdroj tělesného tepla. Je-li vysoká, jde o tzv. tachymetabolizmus, jehož obvykle citovanými příklady jsou – výlučně a bez výjimky – žijící savci a ptáci. Je-li nízká, popisuje se fyziologie zvířete pojmem bradymetabolizmus a za příklad se uvádí většinou šupinatí nebo krokodýli.
Jednou z mnoha otázek, která přestane dávat smysl po přijetí dinosauří příslušnosti ptáků, je ta na dinosauří endotermii. Většina známých dinosaurů samozřejmě endotermní je, můžeme se ptát akorát na to, zda byli endotermní úplně všichni. Také oblíbená otázka, zda dinosauři byli "ektotermní podobně jako dnešní plazi", nebo spíš "endotermní jako žijící savci a ptáci", vůbec nedává smysl. Vyvolává mylný dojem, že žijící amnioty můžeme jednoznačně roztřídit do dvou jasně vymezených fyziologických kategorií, jejichž vnitřní rozdíly zcela ignoruje – ačkoli mohou být právě tak velké, jako rozdíly mezi kategoriemi samými. Většině těch, kteří tuto otázku kladou, navíc vůbec nejde o endotermii jako takovou: až příliš často se míchají dohromady pojmy, které spolu vlastně téměř nesouvisí. Endotermie znamená jen to, že zvíře své teplo získává z vnitřních tělesných procesů a ne z okolního prostředí; tuto podmínku ovšem splňuje i kožatka velká, tuňáci, lamnovití žraloci nebo mečouni, nad nimiž se nikdo příliš nedojímá. Pro rychlý a aktivní způsob života, který je v celé debatě akcentován, je totiž daleko podstatnější metabolická rychlost než zdroj tělesného tepla. Je-li vysoká, jde o tzv. tachymetabolizmus, jehož obvykle citovanými příklady jsou – výlučně a bez výjimky – žijící savci a ptáci. Je-li nízká, popisuje se fyziologie zvířete pojmem bradymetabolizmus a za příklad se uvádí většinou šupinatí nebo krokodýli.
Jenže metabolická rychlost v rámci těchto skupin ani zdaleka není uniformní. Víme to, protože ji umíme kvantifikovat a změřit, např. jako měrnou kyslíkovou spotřebu (V̇O2). Ta nám sděluje, kolik mililitrů kyslíku spotřebuje 1 gram tělesné hmoty zvířete za jednu hodinu. Alternativní jednotkou jsou jouly za sekundu (= watty) nebo za hodinu, které lze na spotřebu kyslíku přepočítat jednoduchou formulkou: příjem 1 mililitru kyslíku je ekvivalentní 20,1 joulům (Schmidt-Nielsen 1984). Metabolickou rychlost dále můžeme měřit v klidovém stavu (bazální metabolický výdej, BMR) nebo naopak při největší fyzické zátěži (maximální metabolický výdej, MMR). Je dobré zdůraznit, že bazální metabolická spotřeba neříká, "kolik tělo musí spálit, jen aby zůstalo naživu", jak se v mnoha textech uvádí; ve spánku lidem často metabolický výdej klesne pod hodnotu BMR (Schmidt-Nielsen 1984), přesto se z něj ráno zase probudíme (...většinou). Mezi extrémy BMR a MMR se pak nachází skutečný denní výdej energie (DEE), který bychom u volně žijících zvířat naměřili nejspíš (proto se mu někdy říká "polní metabolický výdej") – krom BMR zahrnuje přídavné náklady na termoregulaci, trávení nebo růst. Nakonec musíme vzít v úvahu i tělesné rozměry, neboť vztah známý jako "mouse-to-elephant curve" říká, že metabolická rychlost vzrůstá s klesající hmotností – o tom, jak přesně tato závislost vypadá, se biologové hádají už téměř století a není důvod zde tuto debatu rozebírat. Stačí si uvědomit, že fyziologii různých skupin má smysl srovnávat jen na zástupcích o stejné hmotnosti.
I pak ale zjistíme, že v rámci tradičních ektotermů a endotermů existuje značná vnitřní rozmanitost. Tak např. varanovití (Varanidae) konzistentně vykazují daleko vyšší metabolické rychlosti, než je na poměry neptačích sauropsidů ("plazů") obvyklé. Earll (1982) zaznamenal v klidovém stavu u varana bengálského (Varanus bengalensis) průměrný metabolický výdej 0,051 ml O2 g−1 h−1, který byl srovnatelný s ostatními varany, ale výrazně překračoval hodnoty typické pro jiné šupinaté. Zatímco samotný BMR se u varanovitých nezdá být konzistentně vyšší než u jiných šupinatých (Withers 1992)*, míra, o jakou může být eventuálně překročen, už je od příbuzných odlišuje. Thompson & Withers (1997) poznamenali, že MMR varana pruhoocasého (Varanus caudolineatus) je s hodnotou 6,36 ml O2 g−1 h−1 nejvyšší metabolickou rychlostí, jaká kdy byla u šupinatých naměřena, a Seymour et al. (2011) zjistili, že průměr otvůrků pro vyživující cévy na stehenní kosti (který nekoreluje s BMR, ale s MMR) je u varanovitých srovnatelný se savci.
Dále je známo, že ptáci jsou "lepší" tachymetabolici než savci: mají vyšší tělesnou teplotu, krevní tlak, rychlejší cirkulaci krve a dýchání. Ani toto pozorování ale není přesné. Jak ptáci, tak savci se totiž rozpadají nejméně do dvou metabolicky velmi odlišných skupin: pro savce jsou to placentálové oproti vačnatcům a ptakořitným, u ptáků pěvci oproti všem ostatním. Kilogramový vačnatec s tělesnou teplotou okolo 35°C bude mít bazální metabolický výdej okolo 0,4 ml O2 g−1 h−1 (Withers 1992), zatímco stejně velký placentál o tělesné teplotě 38°C na tom bude s 0,6 ml O2 g−1 h−1 prakticky stejně jako průměrný ne-pěvčí pták shodných rozměrů (Withers 1992). Významný nárůst uvidíme až u pěvců s tělesnou teplotou okolo 40,5°C, kteří budou při hmotnosti jednoho kilogramu dosahovat asi 1,1 ml O2 g−1 h−1. Nezapomeňme navíc, že kilogramový pěvec je pěkně velký pěvec: padesátigramový bylinorubec chilský (Phytotoma rara) už dosahuje 2,13 ml O2 g−1 h−1 (Rezende et al. 2002) a dvanáctigramová sýkora horská (Poecile gambeli) ohromujících 4,06 ml O2 g−1 h−1 (tamtéž). Pěvci jsou extrémně rychlí i na poměry tachymetabolických ptáků, s metabolickými výdeji statisticky signifikantně vyššími než u jakýchkoli jiných ptáků stejné velikosti (viz např. Jetz et al. 2008; Sabat et al. 2010; contra Rezende et al. 2002). Jenže právě velikost je nakonec rozhodující, a tak rekordní metabolické rychlosti nakonec nenajdeme u pěvců, nýbrž u kolibříků (Trochilidae).
2. Nejjasnější ohně
Tito drobní američtí svišťouni jsou neuvěřitelně výkonná supertachymetabolická dynama, která i v klidovém stavu vykazují až 615 úderů srdce za minutu, 3 až 4 nádechy za sekundu a tělesnou teplotu, která by pro placentálního savce představovala horečku (Odum 1945; Lasiewski 1964; Hargrove 2005). Asi není třeba zdůrazňovat, že příslušné orgány nemusí tak rychle pracovat pro to, že by byly neefektivní: kolibřík musí dýchat dvacetkrát rychleji než člověk, přestože (nikoli protože) disponuje typicky ptačí průtokovou dýchací soustavou, schopnou okysličovat krev kontinuálně, při nádechu i výdechu. Kapacita difuze kyslíku překonává savce stejných rozměrů více než osminásobně (Dubach 1981). Stejně tak kolibříčí srdce je asi dvakrát větší, než bychom podle alometrického škálování očekávali (Suarez 1998). Klidová spotřeba kyslíku se pohybuje kolem 4 ml O2 g−1 h−1 (Suarez 1992); u největšího zástupce kladu kolibříka velkého (Patagona gigas) potom "jen" 2,7 ml O2 g−1 h−1. Mluvil-li Max Kleiber poeticky o aerobním metabolizmu jako o "ohních života", můžeme spolu se Suarezem a Welchem (2009) bez nadsázky říct, že u kolibříků tyto ohně hoří ze všech obratlovců nejjasněji (viz tabulku níže).
(Populární faktoid [viz zde, zde] říká, že metabolizmus kolibříka je dvanáctkrát rychlejší než u hrdliček a až stokrát rychlejší než u slona. Můj pokus verifikovat tyto údaje dopadl rozporuplně: první je podpořen číselnými údaji např. zde, přičemž uvedená hodnota pro hrdličku karolínskou [po přepočtu asi 1 ml O2 g−1 h−1] dobře odpovídá údajům z AnAge. Dvanáctinásobný rozdíl by znamenal hodnotu 12 ml O2 g−1 h−1 pro kolibříka, která sice neodpovídá BMR, ale skutečnému výdeji odpočívajícího kolibříka docela přesně ano [Lasiewski 1963a]. Srovnávat BMR na jedné straně a DEE na straně druhé však pochopitelně nemá velkou cenu. Sloní BMR podle údajů ze Seymour et al. [2011] činí 0,09 ml O2 g−1 h−1, což je oproti 4 mililitrům kolibříků rozdíl asi 45-násobný.)
Rekord v metabolické rychlosti se však netýká BMR – konec konců, podobně velcí pěvci jej nemají o nic nižší (viz výše). Skutečně neuvěřitelné výkony kolibříci podávají až v pohybu, konkrétně pak během charakteristického třepotavého letu, který skupinu proslavil: pták při něm prostě visí ve vzduchu nad květem, z něhož saje nektar. Méně známé je, že toto vznášení se na místě představuje nejnáročnější formu pohybu, kterou kdy obratlovci vynalezli: spotřeba kyslíku je při něm ještě 2,5× vyšší než při klasickém ptačím dopředném letu (Maina 2000), který také není právě odpočinkovou činností. Pták při něm mávne křídly i 80× za sekundu a těmto rychlostem se přizpůsobuje i zbytek těla. Frekvence dýchání se zrychluje na stěží uvěřitelných 10 nádechů za sekundu (Lasiewski 1964), tep na 1260 úderů za minutu (Hargrove 2005), což znamená, že jeden cyklus cirkulace červených krvinek netrvá déle než 1 sekundu (Suarez & Welch 2009). Jiní obratlovci se takovým výkonům dovedou přiblížit jen dočasným přepnutím svalů na anaerobní glykolýzu, která ale není udržitelná po dobu delší než pár minut. Třepotavý let kolibříků však může trvat i hodinu a nonstop let přes Mexický záliv, který podniká kolibřík rubínohrdlý (Archilochus colubris), zabere hodin dvacet (Suarez 1992).
Jaký metabolizmus stojí za takovými výkony? Kyslíková spotřeba během třepotavého letu byla odhadována na 42 až 85 mililitrů na gram a hodinu – bezkonkurenčně nejvyšší rychlost aerobního metabolizmu, jaká kdy u obratlovce byla zaznamenána (Suarez 1992). Ačkoli horní mez výše uvedeného rozpětí, uvedená Pearsonem (1950) pro třepotavý let kolibříka kalifornského (Selasphorus sasin), je zřejmě přehnaná, její korekce od Lasiewskiho (1963b), kterou jsem použil jako dolní hranici intervalu, stále na rekord pohodlně dosáhne a vysoce překonává srovnatelně malé savce: rychlost metabolizmu běžící sedmigramové myšky africké (Mus minutoides) byla změřena na 15,7 ml O2 g−1 h−1 (Maina 2000). Zdá se navíc, že ani Lasiewskiho korekce nemá obecnou platnost: Wells (1993) zaznamenal hodnoty i okolo šedesátky a průměr jeho údajů činil asi 50 ml O2 g−1 h−1. Rozpor s předchozími odhady blízkými čtyřicítce přisoudil rozdílné náročnosti letu v různých nadmořských výškách.
3. Limity obratlovčí anatomie
Je asi jasné, že s takovými aerobními kapacitami už kolibříci narážejí na horní mez obratlovčí fyziologie, a to hned v několika ohledech.
I pak ale zjistíme, že v rámci tradičních ektotermů a endotermů existuje značná vnitřní rozmanitost. Tak např. varanovití (Varanidae) konzistentně vykazují daleko vyšší metabolické rychlosti, než je na poměry neptačích sauropsidů ("plazů") obvyklé. Earll (1982) zaznamenal v klidovém stavu u varana bengálského (Varanus bengalensis) průměrný metabolický výdej 0,051 ml O2 g−1 h−1, který byl srovnatelný s ostatními varany, ale výrazně překračoval hodnoty typické pro jiné šupinaté. Zatímco samotný BMR se u varanovitých nezdá být konzistentně vyšší než u jiných šupinatých (Withers 1992)*, míra, o jakou může být eventuálně překročen, už je od příbuzných odlišuje. Thompson & Withers (1997) poznamenali, že MMR varana pruhoocasého (Varanus caudolineatus) je s hodnotou 6,36 ml O2 g−1 h−1 nejvyšší metabolickou rychlostí, jaká kdy byla u šupinatých naměřena, a Seymour et al. (2011) zjistili, že průměr otvůrků pro vyživující cévy na stehenní kosti (který nekoreluje s BMR, ale s MMR) je u varanovitých srovnatelný se savci.
Dále je známo, že ptáci jsou "lepší" tachymetabolici než savci: mají vyšší tělesnou teplotu, krevní tlak, rychlejší cirkulaci krve a dýchání. Ani toto pozorování ale není přesné. Jak ptáci, tak savci se totiž rozpadají nejméně do dvou metabolicky velmi odlišných skupin: pro savce jsou to placentálové oproti vačnatcům a ptakořitným, u ptáků pěvci oproti všem ostatním. Kilogramový vačnatec s tělesnou teplotou okolo 35°C bude mít bazální metabolický výdej okolo 0,4 ml O2 g−1 h−1 (Withers 1992), zatímco stejně velký placentál o tělesné teplotě 38°C na tom bude s 0,6 ml O2 g−1 h−1 prakticky stejně jako průměrný ne-pěvčí pták shodných rozměrů (Withers 1992). Významný nárůst uvidíme až u pěvců s tělesnou teplotou okolo 40,5°C, kteří budou při hmotnosti jednoho kilogramu dosahovat asi 1,1 ml O2 g−1 h−1. Nezapomeňme navíc, že kilogramový pěvec je pěkně velký pěvec: padesátigramový bylinorubec chilský (Phytotoma rara) už dosahuje 2,13 ml O2 g−1 h−1 (Rezende et al. 2002) a dvanáctigramová sýkora horská (Poecile gambeli) ohromujících 4,06 ml O2 g−1 h−1 (tamtéž). Pěvci jsou extrémně rychlí i na poměry tachymetabolických ptáků, s metabolickými výdeji statisticky signifikantně vyššími než u jakýchkoli jiných ptáků stejné velikosti (viz např. Jetz et al. 2008; Sabat et al. 2010; contra Rezende et al. 2002). Jenže právě velikost je nakonec rozhodující, a tak rekordní metabolické rychlosti nakonec nenajdeme u pěvců, nýbrž u kolibříků (Trochilidae).
Ať už to bylo s fyziologií druhohorních dinosaurů jakkoli, ti dnešní zahrnují nejtachymetaboličtější obratlovce vůbec. Kolibříci, zde zastoupení kolibříkem fialovotemenným (Thalurania glaucopis), jsou zvířecím ekvivalentem raketového motoru; v přepočtu na gram tělesné hmotnosti spalují obrovské množství kalorií i tehdy, když tiše sedí na větvi. (Zdroj: ibc.lynxeds.com, kredit: Nick Athanas)
2. Nejjasnější ohně
Tito drobní američtí svišťouni jsou neuvěřitelně výkonná supertachymetabolická dynama, která i v klidovém stavu vykazují až 615 úderů srdce za minutu, 3 až 4 nádechy za sekundu a tělesnou teplotu, která by pro placentálního savce představovala horečku (Odum 1945; Lasiewski 1964; Hargrove 2005). Asi není třeba zdůrazňovat, že příslušné orgány nemusí tak rychle pracovat pro to, že by byly neefektivní: kolibřík musí dýchat dvacetkrát rychleji než člověk, přestože (nikoli protože) disponuje typicky ptačí průtokovou dýchací soustavou, schopnou okysličovat krev kontinuálně, při nádechu i výdechu. Kapacita difuze kyslíku překonává savce stejných rozměrů více než osminásobně (Dubach 1981). Stejně tak kolibříčí srdce je asi dvakrát větší, než bychom podle alometrického škálování očekávali (Suarez 1998). Klidová spotřeba kyslíku se pohybuje kolem 4 ml O2 g−1 h−1 (Suarez 1992); u největšího zástupce kladu kolibříka velkého (Patagona gigas) potom "jen" 2,7 ml O2 g−1 h−1. Mluvil-li Max Kleiber poeticky o aerobním metabolizmu jako o "ohních života", můžeme spolu se Suarezem a Welchem (2009) bez nadsázky říct, že u kolibříků tyto ohně hoří ze všech obratlovců nejjasněji (viz tabulku níže).
(Populární faktoid [viz zde, zde] říká, že metabolizmus kolibříka je dvanáctkrát rychlejší než u hrdliček a až stokrát rychlejší než u slona. Můj pokus verifikovat tyto údaje dopadl rozporuplně: první je podpořen číselnými údaji např. zde, přičemž uvedená hodnota pro hrdličku karolínskou [po přepočtu asi 1 ml O2 g−1 h−1] dobře odpovídá údajům z AnAge. Dvanáctinásobný rozdíl by znamenal hodnotu 12 ml O2 g−1 h−1 pro kolibříka, která sice neodpovídá BMR, ale skutečnému výdeji odpočívajícího kolibříka docela přesně ano [Lasiewski 1963a]. Srovnávat BMR na jedné straně a DEE na straně druhé však pochopitelně nemá velkou cenu. Sloní BMR podle údajů ze Seymour et al. [2011] činí 0,09 ml O2 g−1 h−1, což je oproti 4 mililitrům kolibříků rozdíl asi 45-násobný.)
Rekord v metabolické rychlosti se však netýká BMR – konec konců, podobně velcí pěvci jej nemají o nic nižší (viz výše). Skutečně neuvěřitelné výkony kolibříci podávají až v pohybu, konkrétně pak během charakteristického třepotavého letu, který skupinu proslavil: pták při něm prostě visí ve vzduchu nad květem, z něhož saje nektar. Méně známé je, že toto vznášení se na místě představuje nejnáročnější formu pohybu, kterou kdy obratlovci vynalezli: spotřeba kyslíku je při něm ještě 2,5× vyšší než při klasickém ptačím dopředném letu (Maina 2000), který také není právě odpočinkovou činností. Pták při něm mávne křídly i 80× za sekundu a těmto rychlostem se přizpůsobuje i zbytek těla. Frekvence dýchání se zrychluje na stěží uvěřitelných 10 nádechů za sekundu (Lasiewski 1964), tep na 1260 úderů za minutu (Hargrove 2005), což znamená, že jeden cyklus cirkulace červených krvinek netrvá déle než 1 sekundu (Suarez & Welch 2009). Jiní obratlovci se takovým výkonům dovedou přiblížit jen dočasným přepnutím svalů na anaerobní glykolýzu, která ale není udržitelná po dobu delší než pár minut. Třepotavý let kolibříků však může trvat i hodinu a nonstop let přes Mexický záliv, který podniká kolibřík rubínohrdlý (Archilochus colubris), zabere hodin dvacet (Suarez 1992).
Jaký metabolizmus stojí za takovými výkony? Kyslíková spotřeba během třepotavého letu byla odhadována na 42 až 85 mililitrů na gram a hodinu – bezkonkurenčně nejvyšší rychlost aerobního metabolizmu, jaká kdy u obratlovce byla zaznamenána (Suarez 1992). Ačkoli horní mez výše uvedeného rozpětí, uvedená Pearsonem (1950) pro třepotavý let kolibříka kalifornského (Selasphorus sasin), je zřejmě přehnaná, její korekce od Lasiewskiho (1963b), kterou jsem použil jako dolní hranici intervalu, stále na rekord pohodlně dosáhne a vysoce překonává srovnatelně malé savce: rychlost metabolizmu běžící sedmigramové myšky africké (Mus minutoides) byla změřena na 15,7 ml O2 g−1 h−1 (Maina 2000). Zdá se navíc, že ani Lasiewskiho korekce nemá obecnou platnost: Wells (1993) zaznamenal hodnoty i okolo šedesátky a průměr jeho údajů činil asi 50 ml O2 g−1 h−1. Rozpor s předchozími odhady blízkými čtyřicítce přisoudil rozdílné náročnosti letu v různých nadmořských výškách.
Samice kalypty nejmenší (Mellisuga helenae) v třepotavém letu – nejmenší endoterm, nejrychlejší metabolizmus, nejnáročnější pohyb; kombinace, která napíná všechny meze obratlovčího tělního plánu. M. pectoralis a m. supracoracoideus, létací svaly, které ptáka drží ve vzduchu, si pro sebe uzurpují až 90% z celkové tělesné spotřeby kyslíku (Suarez & Welch 2009), díky čemuž jejich tkáň vykazuje největší spotřebu kyslíku na gram mezi obratlovci (Maina 2000) – zhruba desetkrát více než svaly elitních lidských atletů (Hargrove 2005). (Zdroj: arthurgrosset.com)
Srovnání aktivních metabolických rychlostí různých zvířat. Je patrné, že rezavolesklý kolibřík nemá mezi obratlovci konkurenci, a to ani ze strany jiných endotermů o podobných rozměrech, jako je třeba nektarožravá glosofága dlouhojazyčná (na třetím řádku). Pouze hmyz s radikálně odlišnou anatomií a daleko menšími tělesnými rozměry kolibříky v tomto ohledu překonává. Pro detaily, úplná jména taxonů a citace k uvedeným referencím viz původní studii Suareze a Welche. (Zdroj: Suarez & Welch 2009: Table 1)
Srovnání aktivních metabolických rychlostí různých zvířat. Je patrné, že rezavolesklý kolibřík nemá mezi obratlovci konkurenci, a to ani ze strany jiných endotermů o podobných rozměrech, jako je třeba nektarožravá glosofága dlouhojazyčná (na třetím řádku). Pouze hmyz s radikálně odlišnou anatomií a daleko menšími tělesnými rozměry kolibříky v tomto ohledu překonává. Pro detaily, úplná jména taxonů a citace k uvedeným referencím viz původní studii Suareze a Welche. (Zdroj: Suarez & Welch 2009: Table 1)
3. Limity obratlovčí anatomie
Je asi jasné, že s takovými aerobními kapacitami už kolibříci narážejí na horní mez obratlovčí fyziologie, a to hned v několika ohledech.
Především se zdá, že tachymetabolický endoterm už nemůže být o moc menší než 1,8-gramová kalypta nejmenší (Mellisuga helenae)**. Menší velikost by totiž nutně znamenala rychlejší metabolizmus***, a pak už by zvíře nedokázalo jíst dost rychle na to, aby jej dokázalo zásobovat. Sami kolibříci to pěkně ilustrují: hlavní složkou jejich potravy je nektar, v podstatě energetická bomba s vysokým obsahem mono- a di- sacharidů – látek, které lze spalovat daleko rychleji než dlouhé řetězce mastných kyselin. Kolibříci v třepotavém letu se ani nenamáhají syntetizovat z cukrů tuky, 95% metabolické spotřeby pokrývají přímou oxidací sacharózy (Suarez et al. 2011). Ta je dost rychlá na to, aby kolibříkovi umožnila současně napájet termoregulaci, hypertrofované létací svaly a stále vykazovat celkový energetický zisk (Suarez & Gass 2002). I takto vysokoenergetické potravy však do sebe kolibříci musejí denně nasoukat trojnásobek vlastní hmotnosti (Beuchat et al. 1990) – McWhorter & Martínez del Rio (1999) zaznamenali i pětinásobek během 12 hodin, byl-li nektar chudý na sacharózu†. K tomu všemu je ještě třeba připočítat hmyz, jehož konzumací kolibříci kompenzují chudost nektaru na proteiny.
Aby do sebe dokázali takové množství potravy dostat, musí kolibříci jíst prakticky nepřetržitě. Kolibřík rezavolesklý se krmí 14× až 18× za hodinu (Diamond et al. 1986), což z jeho denního rozvrhu překvapivě neukousne tolik, kolik by se mohlo zdát. Každý výboj za nektarem totiž trvá méně než minutu, a tak vlastním krmením ptáci nestráví více než 25% probdělého času (Diamond et al. 1986). Zbylých 75% času kolibřík zdánlivě nečinně prosedí, ačkoli by ho teoreticky mohl využít k hledání další potravy. Zde už však narazila na své limity trávicí soustava: kolibřík by sice mohl jíst ještě o něco rychleji, už by ale pozřenou potravu nestíhal trávit. Omezuje jej totiž rychlost vyprazdňování volete, sama pro změnu omezená rychlostí, s jakou střevo dokáže absorbovat cukry (Karasov et al. 1986).
Dalším omezujícím faktorem je rychlost fungování vylučovací soustavy. Nektar je z větší části voda; kolibřík z něj musí extrahovat cukry a přebytečné vody se rychle zbavit. U jiných ptáků byla stejně jako u lidí zaznamenána tzv. "intoxikace vodou", při níž je voda přijímána rychleji, než ji ledviny stačí odvádět. V důsledku toho se zředí krevní plazma a zhroutí přirozená regulace osmózy: hladina Na+ se sníží pod bezpečnou mez a rostoucí osmotický tlak roztrhá červené krvinky (McWhorter & Martínez del Rio 1999). Sám McWhorter, autor výše citované studie, v komentáři pro ScienceDaily uvedl, že denní obrat vody je u kolibříků vyšší než u vodních obojživelníků a blíží se spíše sladkovodním rybám – naprostou většinu suchozemských zvířat (včetně jiných ptáků) by spolehlivě zabil. Kolibříci tedy musejí mít nějaký důmyslný systém, jak se takového množství vody zbavit. Beuchat et al. (1990) navrhli, že z nektaru velmi rychle extrahují cukry a nechají tenké střevo vstřebat pouze malé množství zbylé vody, zatímco zbytek trávicím traktem volně proteče rovnou ke kloace. Tímto způsobem by šlo obejít ledviny a ušetřit je tak zbytečné práce; McWhorter & Martínez del Rio (1999) nicméně ukázali, že gastrointestinální trakt kolibříků tak ve skutečnosti nepracuje. Bilancí hmotností zjistili, že přes střevní stěnu se vstřebá minimálně 78% požité vody, která tak musí být zpracována ledvinami. Ty se zdají být dobře uzpůsobené k vylučování velkého množství řídké moči, je ovšem zřejmé, že i ony mají své limity: budeme-li kolibříkům podávat příliš zředěný nektar, začnou nakonec ztrácet váhu: aby získali množství cukrů potřebné k jejímu udržení, museli by přijmout víc vody, než by ledviny dokázaly vypudit. McWhorter & Martínez del Rio (1999:2856) píšou, že "the rate at which hummingbird kidneys can process water may impose limits to energy intake", a Suarez & Gass (2002) souhlasí.
V praxi tyto faktory znamenají asi čtyřminutovou mezeru mezi jednotlivými výboji za potravou, kterou už nelze žádným způsobem dále zkrátit: shánět během ní další nektar by znamenalo unavovat se třepotavým letem bez možnosti zisky z této námahy využít. Současně ale tato mezera nemůže být příliš protahována. Méně než čtyři hodiny bez jídla mohou znamenat smrt, je-li kolibřk po celou dobu aktivní. Kolibříci se permanentně nacházejí na pokraji smrti hladem; jsou to ptáci, kteří umírají, když je špatné počasí.
4. Jak spát a neumřít
To ovšem znamená naprosto unikátní problém: jak spát a nenechat se při tom vyhladovět k smrti vlastním metabolizmem?
Řešením je tzv. torpor, což je vlastně zimní mini-spánek, provozovatelný víceméně každodenně. Kolibřík až desetkrát zpomalí svůj metabolizmus (Powers 1991 a reference odtamtud) – Lasiewski (1963a; citován v Geiser 2004) dokonce naměřil u torpidní kalypty růžovohlavé (Calypte anna) pokles o více než 95% oproti BMR. Prudce se snižuje dechová i tepová frekvence; pták se zdá být mrtvý a je zcela bezbranný před případnými predátory. Tělesná teplota velmi prudce klesá, často na teploty blízké okolnímu vzduchu. Standardem je 12,2° až 16,6°C (Bucher & Chappell 1992); zaznamenány však byly i hodnoty pod 10°C (Geiser 2004), hraničící se smrtí podchlazením. Zatímco Lasiewski (1963a) torpor popsal jako "abandoning the homeothermic state", pozdější výzkumy ukázaly, že kolibříci v tomto stavu schopnost udržet si stálou tělesnou teplotu rozhodně neodvrhují – pouze tuto teplotu výrazně snižují. Hainsworth & Wolf (1970) ukázali, že kolibřík nachovohrdlý (Eulampis jugularis) během torporu udržuje své tělo při stálé teplotě 18° až 20°C, a to i tehdy, když ta okolní klesne na pouhých 2,5°C. Jakmile začneme teplotu snižovat pod 18°C, rychlost metabolizmu torpidního kolibříka začne stoupat. Další výzkum potvrdil, že tato schopnost je vlastní i dalším taxonům, a ukázal, že teploty, pod nimiž metabolizmus kolibříků v torporu opět zrychluje, jsou pro různé taxony značně odlišné (Hainsworth & Wolf 1978).
Vzhledem k tomu, že torpor byl po dlouhou dobu jevem známým spíše z laboratoří vybavených kyslíkovými maskami než z volné přírody (v noci se totiž kolibřík špatně hledá), vedly se rozsáhlé spory o to, jak často se k němu volně žijící ptáci vlastně uchylují. Výše v článku zmiňuji, že kolibřík rubínohrdlý zvládne 20 hodin dlouhý let (což je evidentně činnost energeticky velmi náročná) bez jediného mezipřistání a tedy i možnosti nakrmit se – ve srovnání s tím nemůže být přečkání noci velký problém. Na druhou stranu existuje poměrně rozsáhlá (ačkoli anekdotická) evidence, že kolibříci při této cestě běžně umírají hladem (Russell et al. 1992). Aby tomu zabránili, musí rubínohrdlí kolibříci zvýšit svou běžnou tělesnou hmotnost (3 gramy u samců, 3,3 gramy u samic) o dalších 1,7 gramů čistého tuku – jak pro magazín National Wildlife uvedl J. Hargrove, je to "the best use of a gram of fat anywhere in the universe." Toto hromadění tuku ovšem probíhá tempem 0,2 gramů za den (Powers et al. 2003), takže získání minimální postačující zásoby trvá celý týden, a Carpenter & Hixon (1988) ukázali, že minimálně kolibříci rezavolesklí (Selasphorus rufus) právě během tohoto období torpor intenzivně využívají: kdyby to nedělali, připravil by je spánkový metabolizmus o 0,24 g tuku, tedy o všechno, co za den stihli nashromáždit. Migrace A. colubris tedy svědčí spíš o nutnosti torporu než o jeho zbytečnosti.
Neshoda ovšem panovala ohledně toho, zda kolibříci torpor využívají pravidelně ("routine hypothesis"), nebo pouze v případech bezprostředního energetického stresu ("emergency-only hypothesis"). Laboratorní testy dlouho ukazovaly, že kolibříci vstupují do tohoto stavu především tehdy, když omezíme jejich přísun potravy, což by svědčilo spíše pro druhou hypotézu. Carpenter & Hixon (1988) sice pozorovali torpor ve volné přírodě u kolibříka zdravého, dobře živeného a ničím nestresovaného, ten ale měl (už výše zmíněný) jiný postranní motiv, totiž přípravu na migraci. Calder (1994) se jednoznačně přiklonil k variantě emergency-only: výzkumem kolibříků šestibarvých (Selasphorus platycercus) došel k závěru, že ptáci torpor potřebují jen tehdy, pokud se nesetkají s příhodnými podmínkami na zimovišti, jejich krmení přeruší bouřka nebo se jim nepodaří před soumrakem uložit dostatečné rezervy na noc. Bech et al. (1997) na jednu noc odchytili velké množství exemplářů od 3 různých kolibříčích taxonů. V "polo-přírodních" podmínkách do torporu vstoupilo několik jedinců od každého z nich: u jednoho taxonu to byli jedinci s výrazně nižší denní hmotností (a tedy i energetickými rezervami), zatímco u dvou dalších žádná taková korelace zaznamenána nebyla. Jeden taxon (kolibřík černobílý, Florisuga fusca) vykazoval souvislý torpor o délce až 11 hodin, překvapivě častý byl ale vzorec několika kratších torporů během jediné noci. Výrazné rozdíly mezi různými taxony v užívání torporu ve volné přírodě potvrdili i Powers et al. (2003). Ti jej přičetli na vrub teritorialitě: dominantní taxon si dokáže zajistit dostatek tuku na to, aby noc přečkal s normálními metabolickými rychlostmi, zároveň však omezuje přístup k potravě ostatním kolibříkům žijícím na jeho teritoriu, kteří se musí k torporu uchylovat častěji. Kolibřík černobradý (Archilochus alexandri) žijící na území kolibříka Clémenciina (Lampornis clemenciae) využívá torpor skoro každou noc.
Celé téma by šlo uzavřít s tím, že ačkoli v ideálním případě si kolibřík dovede přes den vytvořit tukovou zásobu právě dost velkou na to, aby bez úhony přežil noc s klidovou metabolickou rychlostí (Powers et al. 2003), zdaleka ne vždy se mu to povede. Ať už je příčinou nepříznivé počasí nebo konkurence ze strany jiných kolibříků, jeho jedinou záchranou před vyhladověním se stává torpor. Jeho použití je rizikové – zvyšuje riziko predace, zpomaluje inkubaci a negativně ovlivňuje spánkové vzorce –, je to ale cena, kterou kolibříci platí za nejrychlejší metabolizmus mezi obratlovci.
5. Kolibříci verzus sauropodi
Konečně se dostávám k objasnění druhé části nadpisu dnešního článku. Na úvod ještě podotknu, že bych jen nerad vyvolával dojem, že žijící dinosauři typu kolibříků jsou zajímaví jenom tehdy, když nám mohou říct něco o dinosaurech "pravých", tj. vymřelých. Považuji ale za fascinující, že nejmenší a největší pan-aviani všech dob se mohli potýkat s obdobnými problémy, a to navíc ze stejných důvodů – jinými slovy, že horní i dolní mez obratlovčích rozměrů mohou určovat stejné faktory. Kdo je protějškem kolibříků na druhém konci velikostního spektra?
Byli to sauropodi, čtyřnozí dinosauři dorůstající do desítek metrů a tun. Přestože jejich tělesný plán se může zdát ptákům extrémně nepodobný, obě skupiny vykazují několik podobností, pravděpodobně zděděných od společného dinosauřího předka: sem spadá třeba mimořádně účinná průtoková dýchací soustava se vzdušnými vaky, zasahujícími dovnitř obratlů. Sauropody zřejmě omezovaly také stejné velikostní limity jako dnešní ptáky: např. maximální rychlost příjmu potravy byla dokonce prezentována jako důvod, proč tito dinosauři nemohli být endotermní. Je známo, že endotermové potřebují v poměru k tělesné hmotnosti asi desetkrát více potravy než ektotermové, a od určité velikosti už by pro ně (i se všemi výhodami rychlého metabolizmu) mělo být nemožné si takové množství potravy obstarat. Midgley et al. (2002) argumentovali prostě: den má jen 24 hodin, a už sloni (jen zcela výjimečně přesahující 10 tun) tráví sháněním potravy 80% času. Zvíře musí krmení aspoň občas přerušit spánkem (viz opět kolibříky), a tak už by o moc větší tachymetabolický endoterm neměl existovat. Ve skutečnosti však autoři dokázali jen to, že o moc větší nemohou být sloni: jak podotkli Sander et al. (2010), sauropodi se nezdržovali žvýkáním, což jejich příjem potravy podstatně urychlovalo, a i efektivita jejich trávení mohla být v porovnání se slony mnohem vyšší. Weaver (1983) zase založila svůj argument na propočtech BMR a z toho vyplývajících potravních nároků. 15-tunový Brachiosaurus by mohl být endotermní, pokud by konzumoval potravu rychlostí slona, tj. asi 200 kg za den; 40 tun těžký endoterm by se ještě uživil, pokud by žral výhradně vysokoenergetické cykasy a jehličnany, a 55 tun těžkého sauropoda (za jakého byl tehdy považován např. Ultrasauros, ve skutečnosti chiméra založená z velké části na materiálu velkého brachiosaura) už by rychlý metabolizmus nutně vyhladověl k smrti.
Podle Weaver je ale brachiosaurovi s malou hlavou na dlouhém krku daleko bližší žirafa, která potravu přijímá daleko pomalejším tempem – jen kolem 50 kg denně. Pak by ovšem Brachiosaurus nemohl být tachymetabolický vůbec. Problém je v tom, že Weaver (1983) vzala analogii mezi brachiosaurem a žirafou až příliš daleko: předpokládala, že hlava obou zvířat a kapacita jejich tlamy byla stejně velká. S tímto omylem rychle skoncoval Paul (1998): hlava brachiosaura je nejen asi dvakrát větší, ale především skoro celá tvořená obrovskou prostornou tlamou, která by se svým půl metrem šířky (ve srovnání s asi 10 cm žirafy) bez problému pojmula celou žirafí hlavu. I tento argument tedy selhal a dnes je obecně uznávaným faktem, že sauropodi měli vysoké BMR plně srovnatelné s moderními placentálními savci (Sander et al. 2010) – dokonce se zdá, že tak rychlý metabolizmus je pro dosažení podobných velikostí podmínkou.
Přestože limity na tělesnou velikost dané potravními nároky určitě neznemožňují tachymetabolizmus sauropodů, přece jen existují. Určitá plocha souše je totiž schopná uživit jen určité množství zvířat, přičemž platí, že zvířata s rychlým metabolizmem mají řádově větší potravní nároky než zvířata s metabolizmem pomalým, a že větší zvířata spotřebují více potravy než ta menší. Dostatečně velkých tachymetabolických zvířat už by pevniny uživily tak málo, že by to nepostačilo k udržení minimálních hodnot populační hustoty, bránících taxon před náhodným vymřením (Sander et al. 2010). Sauropodi se tedy nakonec přece jen potýkali s podobným problémem jako kolibříci, byť jde o podobnost spíše povrchní: kolibříci nemohou být menší, než jsou, protože by je jejich metabolizmus nutil jíst rychleji, než obratlovčí anatomie umožňuje; sauropodi nemohli být větší, než byli, protože by je jejich metabolizmus nutil jíst tolik, že by jim nároky na potravu znemožňovaly obsadit pevninu dostatečně velkou a hustou populací.
Velikost sauropodů ovšem mohl omezovat ještě jeden faktor, a to jejich tělesná teplota. Gillooly et al. (2006) spočítali tělesnou teplotu různých neptačích dinosaurů podle dříve publikovaného vztahu, který tento faktor dává do souvislosti s rozměry a rychlostí růstu, tedy údaji odhadnutelnými přímo z fosilního záznamu. Zjistili, že tělesná teplota u dinosaurů rostla v závislosti na hmotnosti. U 12 kg těžkého psittakosaura měla činit pouhých 25°C (což je hluboko pod 32°C typickými pro ptakořitné, nejpomalejší z tachymetaboliků), u 13 tun vážícího apatosaura už 41°C, což je plně srovnatelné s extrémně tachymetabolickými pěvci. Platí-li tento vztah, 55 tun těžký sauropod už měl disponovat tělesnou teplotou 48°C, což je nejzazší hodnota, jakou si tělo ještě může dovolit: výš už by docházelo k denaturaci životně důležitých proteinů.
Zde bych nicméně byl v načrtávání paralel s kolibříky opatrnější. Zdá se logické, že u těchto ptáků by nejvyšší metabolické rychlosti měla doprovázet také nejvyšší tělesná teplota; skutečné údaje však svědčí o něčem jiném. Za hodnotami srovnatelnými s horečkou u placentálů (viz výše) si stojím, kolibříci ale v tomto ohledu nemusí nutně vybočovat z ptačího průměru. Přestože rané odhady šplhaly až ke stěží uvěřitelným 44,6°C pro kolibříka temného (Aphantochroa cirrochloris; Ruschi 1949), Lasiewski (1964) nahlásil od devíti různých taxonů teploty pohybující se od 41,2°C po pouhých 34,4°C (pravděpodobně ve spánku), což nijak nevybočuje z hodnot typických pro nepěvčí ptáky. Morrison (1962) prozkoumal tři taxony a zjistil, že u bdělých ptáků se tělesná teplota pohybovala od 38,4° po 39,3°C, přičemž intenzivní fyzická aktivita mohla tyto hodnoty ještě o dva stupně zvýšit. Určení tělesné teploty však brání jak její závislost na stavu zvířete (jiná je při intenzivní aktivitě, odpočinku, spánku a torporu), tak i mezitaxonové rozdíly (menší kolibříci mají nižší tělesnou teplotu než ti větší) a také prostý fakt, že u podobně malých zvířat se tělesná teplota špatně měří (Bech et al. 1997). Přesto se zdá, že kolibříci v tomto ohledu rekordmany spíše nebudou: u pěvců tělesná teplota dosahuje běžně 42°C a u holubů je z nějakého důvodu ještě vyšší (McNab 1966).
Srovnávání se sauropody si tedy kolibříci v tomto ohledu zdánlivě nezaslouží, což ovšem příliš nevadí – studie posledních let ukázaly, že ani sauropodi zřejme nebyli tak horkokrevní, jak si je Gillooly a spol. představovali. S dnešními metodami je už totiž možné určit tělesnou teplotu fosilních zvířat víceméně přímo, z poměrů izotopů kyslíku a uhlíku v minerálech biogenního původu. Práce využívající tuto metodu ukázaly, že dinosauří teplota se s velikostí příliš neměnila: Amiot et al. (2006) zaznamenávali konstantní hodnotu 36° až 37°C bez ohledu na velikost (která se v jejich taxonomickém vzorku pohybovala mezi 10 kg a 9 tunami) a Eagle et al. (2011) určili tělesnou teplotu brachiosaura a kamarasaura na 36° až 38°C, přestože podle modelu Gilloolyho a spol. by se takto velké taxony měly potácet kolem dvaačtyřicítky. Důvod se zdá být prostý: sauropodi byli praví endotermové, nikoli "gigantotermové", což je spíš hypotetická kategorie zvířat, která si díky své velikosti udržují stálou tělesnou teplotu i přesto, že jsou tepelně závislí na okolním prostředí. Otázkou je, v jakém místě svých kalkulací udělali Gillooly et al. (2006) chybu; pravděpodobně to byly přehnané odhady tempa růstu (Sander et al. 2010).
*K původní Withersově práci nemám přístup, velmi užitečné údaje z jeho tabulek 4 a 5 (porovnávajících metabolické rychlosti u stejně velkých zástupců různých skupin) však byly přetištěny zde.
**Což ukazuje např. i fakt, že endotermní obratlovci se na této velikosti zasekli hned třikrát. Hmotnost nejmenších savců, netopýrka thajského (Craseonycteris thonglongyai) a bělozubky nejmenší (Suncus etruscus), se také pohybuje okolo 2 gramů; zdá se tedy, že kdyby šlo jít ještě níže, někdo už by tam došel.
***Důvod pro tuto spojitost není zcela zřejmý. Klasická teorie říká, že menší zvířata mají nepříznivý poměr mezi povrchem a objemem těla (dvojnásobné zmenšení lineárních rozměrů znamená 8× menší objem, ale jen 4× menší povrch) a rostoucí tepelné ztráty tedy musí kompenzovat vyšším metabolizmem, což je sice pěkné, ale matematicky to nefunguje – křivka v grafu závislosti BMR na hmotnosti nevykazuje potřebný sklon. Ve hře je podstatně více faktorů, ale role tepelných ztrát je stále značná.
†Malé srovnání: webové faktoidy konstatují, že myš sní ekvivalent vlastní hmotnosti za 2 dny, člověk za 50.
Aby do sebe dokázali takové množství potravy dostat, musí kolibříci jíst prakticky nepřetržitě. Kolibřík rezavolesklý se krmí 14× až 18× za hodinu (Diamond et al. 1986), což z jeho denního rozvrhu překvapivě neukousne tolik, kolik by se mohlo zdát. Každý výboj za nektarem totiž trvá méně než minutu, a tak vlastním krmením ptáci nestráví více než 25% probdělého času (Diamond et al. 1986). Zbylých 75% času kolibřík zdánlivě nečinně prosedí, ačkoli by ho teoreticky mohl využít k hledání další potravy. Zde už však narazila na své limity trávicí soustava: kolibřík by sice mohl jíst ještě o něco rychleji, už by ale pozřenou potravu nestíhal trávit. Omezuje jej totiž rychlost vyprazdňování volete, sama pro změnu omezená rychlostí, s jakou střevo dokáže absorbovat cukry (Karasov et al. 1986).
Dalším omezujícím faktorem je rychlost fungování vylučovací soustavy. Nektar je z větší části voda; kolibřík z něj musí extrahovat cukry a přebytečné vody se rychle zbavit. U jiných ptáků byla stejně jako u lidí zaznamenána tzv. "intoxikace vodou", při níž je voda přijímána rychleji, než ji ledviny stačí odvádět. V důsledku toho se zředí krevní plazma a zhroutí přirozená regulace osmózy: hladina Na+ se sníží pod bezpečnou mez a rostoucí osmotický tlak roztrhá červené krvinky (McWhorter & Martínez del Rio 1999). Sám McWhorter, autor výše citované studie, v komentáři pro ScienceDaily uvedl, že denní obrat vody je u kolibříků vyšší než u vodních obojživelníků a blíží se spíše sladkovodním rybám – naprostou většinu suchozemských zvířat (včetně jiných ptáků) by spolehlivě zabil. Kolibříci tedy musejí mít nějaký důmyslný systém, jak se takového množství vody zbavit. Beuchat et al. (1990) navrhli, že z nektaru velmi rychle extrahují cukry a nechají tenké střevo vstřebat pouze malé množství zbylé vody, zatímco zbytek trávicím traktem volně proteče rovnou ke kloace. Tímto způsobem by šlo obejít ledviny a ušetřit je tak zbytečné práce; McWhorter & Martínez del Rio (1999) nicméně ukázali, že gastrointestinální trakt kolibříků tak ve skutečnosti nepracuje. Bilancí hmotností zjistili, že přes střevní stěnu se vstřebá minimálně 78% požité vody, která tak musí být zpracována ledvinami. Ty se zdají být dobře uzpůsobené k vylučování velkého množství řídké moči, je ovšem zřejmé, že i ony mají své limity: budeme-li kolibříkům podávat příliš zředěný nektar, začnou nakonec ztrácet váhu: aby získali množství cukrů potřebné k jejímu udržení, museli by přijmout víc vody, než by ledviny dokázaly vypudit. McWhorter & Martínez del Rio (1999:2856) píšou, že "the rate at which hummingbird kidneys can process water may impose limits to energy intake", a Suarez & Gass (2002) souhlasí.
V praxi tyto faktory znamenají asi čtyřminutovou mezeru mezi jednotlivými výboji za potravou, kterou už nelze žádným způsobem dále zkrátit: shánět během ní další nektar by znamenalo unavovat se třepotavým letem bez možnosti zisky z této námahy využít. Současně ale tato mezera nemůže být příliš protahována. Méně než čtyři hodiny bez jídla mohou znamenat smrt, je-li kolibřk po celou dobu aktivní. Kolibříci se permanentně nacházejí na pokraji smrti hladem; jsou to ptáci, kteří umírají, když je špatné počasí.
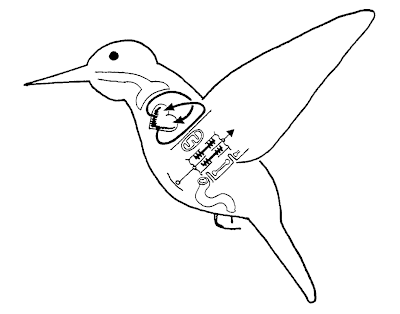
Schematický diagram kolibříka v letu, zobrazující komponenty zásadní pro transport kyslíku a oxidaci sacharózy, dva procesy, které umožňují nevídaně vysokou rychlost příjmu a výdeje energie. Velké hrudní svaly sestávají výhradně z rychlých bílých ("fast-twitch") vláken (Suarez & Welch 2009) se zvýšenou koncentrací mitochondrií, které vyžadují extrémně rychlý přísun O2. Ten klade zvýšené nároky na kardiovaskulární, dýchací a gastrointestinální soustavu. (Zdroj: Suarez 1998: Figure 1)
4. Jak spát a neumřít
To ovšem znamená naprosto unikátní problém: jak spát a nenechat se při tom vyhladovět k smrti vlastním metabolizmem?
Řešením je tzv. torpor, což je vlastně zimní mini-spánek, provozovatelný víceméně každodenně. Kolibřík až desetkrát zpomalí svůj metabolizmus (Powers 1991 a reference odtamtud) – Lasiewski (1963a; citován v Geiser 2004) dokonce naměřil u torpidní kalypty růžovohlavé (Calypte anna) pokles o více než 95% oproti BMR. Prudce se snižuje dechová i tepová frekvence; pták se zdá být mrtvý a je zcela bezbranný před případnými predátory. Tělesná teplota velmi prudce klesá, často na teploty blízké okolnímu vzduchu. Standardem je 12,2° až 16,6°C (Bucher & Chappell 1992); zaznamenány však byly i hodnoty pod 10°C (Geiser 2004), hraničící se smrtí podchlazením. Zatímco Lasiewski (1963a) torpor popsal jako "abandoning the homeothermic state", pozdější výzkumy ukázaly, že kolibříci v tomto stavu schopnost udržet si stálou tělesnou teplotu rozhodně neodvrhují – pouze tuto teplotu výrazně snižují. Hainsworth & Wolf (1970) ukázali, že kolibřík nachovohrdlý (Eulampis jugularis) během torporu udržuje své tělo při stálé teplotě 18° až 20°C, a to i tehdy, když ta okolní klesne na pouhých 2,5°C. Jakmile začneme teplotu snižovat pod 18°C, rychlost metabolizmu torpidního kolibříka začne stoupat. Další výzkum potvrdil, že tato schopnost je vlastní i dalším taxonům, a ukázal, že teploty, pod nimiž metabolizmus kolibříků v torporu opět zrychluje, jsou pro různé taxony značně odlišné (Hainsworth & Wolf 1978).
Vzhledem k tomu, že torpor byl po dlouhou dobu jevem známým spíše z laboratoří vybavených kyslíkovými maskami než z volné přírody (v noci se totiž kolibřík špatně hledá), vedly se rozsáhlé spory o to, jak často se k němu volně žijící ptáci vlastně uchylují. Výše v článku zmiňuji, že kolibřík rubínohrdlý zvládne 20 hodin dlouhý let (což je evidentně činnost energeticky velmi náročná) bez jediného mezipřistání a tedy i možnosti nakrmit se – ve srovnání s tím nemůže být přečkání noci velký problém. Na druhou stranu existuje poměrně rozsáhlá (ačkoli anekdotická) evidence, že kolibříci při této cestě běžně umírají hladem (Russell et al. 1992). Aby tomu zabránili, musí rubínohrdlí kolibříci zvýšit svou běžnou tělesnou hmotnost (3 gramy u samců, 3,3 gramy u samic) o dalších 1,7 gramů čistého tuku – jak pro magazín National Wildlife uvedl J. Hargrove, je to "the best use of a gram of fat anywhere in the universe." Toto hromadění tuku ovšem probíhá tempem 0,2 gramů za den (Powers et al. 2003), takže získání minimální postačující zásoby trvá celý týden, a Carpenter & Hixon (1988) ukázali, že minimálně kolibříci rezavolesklí (Selasphorus rufus) právě během tohoto období torpor intenzivně využívají: kdyby to nedělali, připravil by je spánkový metabolizmus o 0,24 g tuku, tedy o všechno, co za den stihli nashromáždit. Migrace A. colubris tedy svědčí spíš o nutnosti torporu než o jeho zbytečnosti.
Neshoda ovšem panovala ohledně toho, zda kolibříci torpor využívají pravidelně ("routine hypothesis"), nebo pouze v případech bezprostředního energetického stresu ("emergency-only hypothesis"). Laboratorní testy dlouho ukazovaly, že kolibříci vstupují do tohoto stavu především tehdy, když omezíme jejich přísun potravy, což by svědčilo spíše pro druhou hypotézu. Carpenter & Hixon (1988) sice pozorovali torpor ve volné přírodě u kolibříka zdravého, dobře živeného a ničím nestresovaného, ten ale měl (už výše zmíněný) jiný postranní motiv, totiž přípravu na migraci. Calder (1994) se jednoznačně přiklonil k variantě emergency-only: výzkumem kolibříků šestibarvých (Selasphorus platycercus) došel k závěru, že ptáci torpor potřebují jen tehdy, pokud se nesetkají s příhodnými podmínkami na zimovišti, jejich krmení přeruší bouřka nebo se jim nepodaří před soumrakem uložit dostatečné rezervy na noc. Bech et al. (1997) na jednu noc odchytili velké množství exemplářů od 3 různých kolibříčích taxonů. V "polo-přírodních" podmínkách do torporu vstoupilo několik jedinců od každého z nich: u jednoho taxonu to byli jedinci s výrazně nižší denní hmotností (a tedy i energetickými rezervami), zatímco u dvou dalších žádná taková korelace zaznamenána nebyla. Jeden taxon (kolibřík černobílý, Florisuga fusca) vykazoval souvislý torpor o délce až 11 hodin, překvapivě častý byl ale vzorec několika kratších torporů během jediné noci. Výrazné rozdíly mezi různými taxony v užívání torporu ve volné přírodě potvrdili i Powers et al. (2003). Ti jej přičetli na vrub teritorialitě: dominantní taxon si dokáže zajistit dostatek tuku na to, aby noc přečkal s normálními metabolickými rychlostmi, zároveň však omezuje přístup k potravě ostatním kolibříkům žijícím na jeho teritoriu, kteří se musí k torporu uchylovat častěji. Kolibřík černobradý (Archilochus alexandri) žijící na území kolibříka Clémenciina (Lampornis clemenciae) využívá torpor skoro každou noc.
Celé téma by šlo uzavřít s tím, že ačkoli v ideálním případě si kolibřík dovede přes den vytvořit tukovou zásobu právě dost velkou na to, aby bez úhony přežil noc s klidovou metabolickou rychlostí (Powers et al. 2003), zdaleka ne vždy se mu to povede. Ať už je příčinou nepříznivé počasí nebo konkurence ze strany jiných kolibříků, jeho jedinou záchranou před vyhladověním se stává torpor. Jeho použití je rizikové – zvyšuje riziko predace, zpomaluje inkubaci a negativně ovlivňuje spánkové vzorce –, je to ale cena, kterou kolibříci platí za nejrychlejší metabolizmus mezi obratlovci.
5. Kolibříci verzus sauropodi
Konečně se dostávám k objasnění druhé části nadpisu dnešního článku. Na úvod ještě podotknu, že bych jen nerad vyvolával dojem, že žijící dinosauři typu kolibříků jsou zajímaví jenom tehdy, když nám mohou říct něco o dinosaurech "pravých", tj. vymřelých. Považuji ale za fascinující, že nejmenší a největší pan-aviani všech dob se mohli potýkat s obdobnými problémy, a to navíc ze stejných důvodů – jinými slovy, že horní i dolní mez obratlovčích rozměrů mohou určovat stejné faktory. Kdo je protějškem kolibříků na druhém konci velikostního spektra?
Byli to sauropodi, čtyřnozí dinosauři dorůstající do desítek metrů a tun. Přestože jejich tělesný plán se může zdát ptákům extrémně nepodobný, obě skupiny vykazují několik podobností, pravděpodobně zděděných od společného dinosauřího předka: sem spadá třeba mimořádně účinná průtoková dýchací soustava se vzdušnými vaky, zasahujícími dovnitř obratlů. Sauropody zřejmě omezovaly také stejné velikostní limity jako dnešní ptáky: např. maximální rychlost příjmu potravy byla dokonce prezentována jako důvod, proč tito dinosauři nemohli být endotermní. Je známo, že endotermové potřebují v poměru k tělesné hmotnosti asi desetkrát více potravy než ektotermové, a od určité velikosti už by pro ně (i se všemi výhodami rychlého metabolizmu) mělo být nemožné si takové množství potravy obstarat. Midgley et al. (2002) argumentovali prostě: den má jen 24 hodin, a už sloni (jen zcela výjimečně přesahující 10 tun) tráví sháněním potravy 80% času. Zvíře musí krmení aspoň občas přerušit spánkem (viz opět kolibříky), a tak už by o moc větší tachymetabolický endoterm neměl existovat. Ve skutečnosti však autoři dokázali jen to, že o moc větší nemohou být sloni: jak podotkli Sander et al. (2010), sauropodi se nezdržovali žvýkáním, což jejich příjem potravy podstatně urychlovalo, a i efektivita jejich trávení mohla být v porovnání se slony mnohem vyšší. Weaver (1983) zase založila svůj argument na propočtech BMR a z toho vyplývajících potravních nároků. 15-tunový Brachiosaurus by mohl být endotermní, pokud by konzumoval potravu rychlostí slona, tj. asi 200 kg za den; 40 tun těžký endoterm by se ještě uživil, pokud by žral výhradně vysokoenergetické cykasy a jehličnany, a 55 tun těžkého sauropoda (za jakého byl tehdy považován např. Ultrasauros, ve skutečnosti chiméra založená z velké části na materiálu velkého brachiosaura) už by rychlý metabolizmus nutně vyhladověl k smrti.
Podle Weaver je ale brachiosaurovi s malou hlavou na dlouhém krku daleko bližší žirafa, která potravu přijímá daleko pomalejším tempem – jen kolem 50 kg denně. Pak by ovšem Brachiosaurus nemohl být tachymetabolický vůbec. Problém je v tom, že Weaver (1983) vzala analogii mezi brachiosaurem a žirafou až příliš daleko: předpokládala, že hlava obou zvířat a kapacita jejich tlamy byla stejně velká. S tímto omylem rychle skoncoval Paul (1998): hlava brachiosaura je nejen asi dvakrát větší, ale především skoro celá tvořená obrovskou prostornou tlamou, která by se svým půl metrem šířky (ve srovnání s asi 10 cm žirafy) bez problému pojmula celou žirafí hlavu. I tento argument tedy selhal a dnes je obecně uznávaným faktem, že sauropodi měli vysoké BMR plně srovnatelné s moderními placentálními savci (Sander et al. 2010) – dokonce se zdá, že tak rychlý metabolizmus je pro dosažení podobných velikostí podmínkou.
Přestože limity na tělesnou velikost dané potravními nároky určitě neznemožňují tachymetabolizmus sauropodů, přece jen existují. Určitá plocha souše je totiž schopná uživit jen určité množství zvířat, přičemž platí, že zvířata s rychlým metabolizmem mají řádově větší potravní nároky než zvířata s metabolizmem pomalým, a že větší zvířata spotřebují více potravy než ta menší. Dostatečně velkých tachymetabolických zvířat už by pevniny uživily tak málo, že by to nepostačilo k udržení minimálních hodnot populační hustoty, bránících taxon před náhodným vymřením (Sander et al. 2010). Sauropodi se tedy nakonec přece jen potýkali s podobným problémem jako kolibříci, byť jde o podobnost spíše povrchní: kolibříci nemohou být menší, než jsou, protože by je jejich metabolizmus nutil jíst rychleji, než obratlovčí anatomie umožňuje; sauropodi nemohli být větší, než byli, protože by je jejich metabolizmus nutil jíst tolik, že by jim nároky na potravu znemožňovaly obsadit pevninu dostatečně velkou a hustou populací.
Velikost sauropodů ovšem mohl omezovat ještě jeden faktor, a to jejich tělesná teplota. Gillooly et al. (2006) spočítali tělesnou teplotu různých neptačích dinosaurů podle dříve publikovaného vztahu, který tento faktor dává do souvislosti s rozměry a rychlostí růstu, tedy údaji odhadnutelnými přímo z fosilního záznamu. Zjistili, že tělesná teplota u dinosaurů rostla v závislosti na hmotnosti. U 12 kg těžkého psittakosaura měla činit pouhých 25°C (což je hluboko pod 32°C typickými pro ptakořitné, nejpomalejší z tachymetaboliků), u 13 tun vážícího apatosaura už 41°C, což je plně srovnatelné s extrémně tachymetabolickými pěvci. Platí-li tento vztah, 55 tun těžký sauropod už měl disponovat tělesnou teplotou 48°C, což je nejzazší hodnota, jakou si tělo ještě může dovolit: výš už by docházelo k denaturaci životně důležitých proteinů.
Zde bych nicméně byl v načrtávání paralel s kolibříky opatrnější. Zdá se logické, že u těchto ptáků by nejvyšší metabolické rychlosti měla doprovázet také nejvyšší tělesná teplota; skutečné údaje však svědčí o něčem jiném. Za hodnotami srovnatelnými s horečkou u placentálů (viz výše) si stojím, kolibříci ale v tomto ohledu nemusí nutně vybočovat z ptačího průměru. Přestože rané odhady šplhaly až ke stěží uvěřitelným 44,6°C pro kolibříka temného (Aphantochroa cirrochloris; Ruschi 1949), Lasiewski (1964) nahlásil od devíti různých taxonů teploty pohybující se od 41,2°C po pouhých 34,4°C (pravděpodobně ve spánku), což nijak nevybočuje z hodnot typických pro nepěvčí ptáky. Morrison (1962) prozkoumal tři taxony a zjistil, že u bdělých ptáků se tělesná teplota pohybovala od 38,4° po 39,3°C, přičemž intenzivní fyzická aktivita mohla tyto hodnoty ještě o dva stupně zvýšit. Určení tělesné teploty však brání jak její závislost na stavu zvířete (jiná je při intenzivní aktivitě, odpočinku, spánku a torporu), tak i mezitaxonové rozdíly (menší kolibříci mají nižší tělesnou teplotu než ti větší) a také prostý fakt, že u podobně malých zvířat se tělesná teplota špatně měří (Bech et al. 1997). Přesto se zdá, že kolibříci v tomto ohledu rekordmany spíše nebudou: u pěvců tělesná teplota dosahuje běžně 42°C a u holubů je z nějakého důvodu ještě vyšší (McNab 1966).
Srovnávání se sauropody si tedy kolibříci v tomto ohledu zdánlivě nezaslouží, což ovšem příliš nevadí – studie posledních let ukázaly, že ani sauropodi zřejme nebyli tak horkokrevní, jak si je Gillooly a spol. představovali. S dnešními metodami je už totiž možné určit tělesnou teplotu fosilních zvířat víceméně přímo, z poměrů izotopů kyslíku a uhlíku v minerálech biogenního původu. Práce využívající tuto metodu ukázaly, že dinosauří teplota se s velikostí příliš neměnila: Amiot et al. (2006) zaznamenávali konstantní hodnotu 36° až 37°C bez ohledu na velikost (která se v jejich taxonomickém vzorku pohybovala mezi 10 kg a 9 tunami) a Eagle et al. (2011) určili tělesnou teplotu brachiosaura a kamarasaura na 36° až 38°C, přestože podle modelu Gilloolyho a spol. by se takto velké taxony měly potácet kolem dvaačtyřicítky. Důvod se zdá být prostý: sauropodi byli praví endotermové, nikoli "gigantotermové", což je spíš hypotetická kategorie zvířat, která si díky své velikosti udržují stálou tělesnou teplotu i přesto, že jsou tepelně závislí na okolním prostředí. Otázkou je, v jakém místě svých kalkulací udělali Gillooly et al. (2006) chybu; pravděpodobně to byly přehnané odhady tempa růstu (Sander et al. 2010).
*K původní Withersově práci nemám přístup, velmi užitečné údaje z jeho tabulek 4 a 5 (porovnávajících metabolické rychlosti u stejně velkých zástupců různých skupin) však byly přetištěny zde.
**Což ukazuje např. i fakt, že endotermní obratlovci se na této velikosti zasekli hned třikrát. Hmotnost nejmenších savců, netopýrka thajského (Craseonycteris thonglongyai) a bělozubky nejmenší (Suncus etruscus), se také pohybuje okolo 2 gramů; zdá se tedy, že kdyby šlo jít ještě níže, někdo už by tam došel.
***Důvod pro tuto spojitost není zcela zřejmý. Klasická teorie říká, že menší zvířata mají nepříznivý poměr mezi povrchem a objemem těla (dvojnásobné zmenšení lineárních rozměrů znamená 8× menší objem, ale jen 4× menší povrch) a rostoucí tepelné ztráty tedy musí kompenzovat vyšším metabolizmem, což je sice pěkné, ale matematicky to nefunguje – křivka v grafu závislosti BMR na hmotnosti nevykazuje potřebný sklon. Ve hře je podstatně více faktorů, ale role tepelných ztrát je stále značná.
†Malé srovnání: webové faktoidy konstatují, že myš sní ekvivalent vlastní hmotnosti za 2 dny, člověk za 50.
Zdroje:
- http://www.scribd.com/doc/51793941/Calculators
- http://www.stanford.edu/group/stanfordbirds/text/essays/Metabolism.html
- http://genomics.senescence.info/species/entry.php?species=Zenaida_macroura
- http://www.learner.org/jnorth/tm/humm/EnergyTorpor.html
- http://www.sciencedaily.com/releases/2002/04/020402075641.htm
- http://www.nwf.org/.../National-Wildlife/Birds/Archives/2011/Tracking-Migratory-Birds...
- Amiot R, Lecuyer C, Buffetaut E, Escarguel G, Fluteau F, Martineau F 2006 Oxygen isotopes from biogenic appetites suggest widespread endothermy in Cretaceous dinosaurs. Earth Planet Sci Lett 246(1–2): 41–54
- Bech C, Abe AS, Steffensen JF, Berger M, Bicudo JEPW 1997 Torpor in three species of Brazilian hummingbirds under semi-natural conditions. The Condor 99: 780–8
- Beuchat CA, Calder WA III, Braun EJ 1990 The integration of osmoregulation and energy balance in hummingbirds. Physiol Zool 63(6): 1059–81
- Bucher TL, Chappell MA 1992 Ventilatory and metabolic dynamics during entry into and arousal from torpor in Selasphorus hummingbirds. Physiol Zool 65: 978–93
- Calder WA 1994 When do hummingbirds use torpor in nature? Physiol Zool 67(5): 1051–76
- Carpenter FL, Hixon MA 1988 A new function for torpor: fat conservation in a wild migrant hummingbird. The Condor 90: 373–8
- Diamond JM, Karasov WH, Phan D, Carpenter FL 1986 Digestive physiology is a determinant of foraging bout frequency in hummingbirds. Nature 320(6057): 62–3
- Dubach M 1981 Quantitative analysis of the respiratory system of the house sparrow, budgerigar and violet-eared hummingbird. Respir Physiol 46: 43–60
- Eagle RA, Tütken T, Martin TS, Tripati AK, Fricke HC, Connely M, Cifelli RL, Eiler JM 2011 Dinosaur body temperature determined from isotopic (13C-18O) ordering in fossil biominerals. Science 333(6041): 443–5
- Earll CR 1982 Heating, cooling and oxygen consumption rates in Varanus bengalensis. Comp Biochem Physiol A Mol Integr Physiol 72(2): 377–81
- Geiser F 2004 Metabolic rate and body temperature reduction during hibernation and daily torpor. Annu Rev Physiol 66: 239–74
- Gillooly JF, Allen AP, Charnov EL 2006 Dinosaur fossils predict body temperatures. PLoS Biol 4(8): e248
- Hainsworth FR, Wolf LL 1970 Regulation of oxygen consumption and body temperature during torpor in a hummingbird, Eulampis jugularis. Science 168(3929): 368–9
- Hainsworth FR, Wolf LL 1978 Regulation of metabolism during torpor in “temperate” zone hummingbirds. The Auk 95: 197–9
- Hargrove JL 2005 Adipose energy stores, physical work, and the metabolic syndrome: lessons from hummingbirds. Nutr J 4:36
- Jetz W, Freckleton RP, McKechnie AE 2008 Environment, migratory tendency, phylogeny and basal metabolic rate in birds. PLoS ONE 3(9): e3261
- Karasov WH, Phan D, Diamond JM, Carpenter FL 1986 Food passage and intestinal nutrient absorption in hummingbirds. The Auk 103: 453–64
- Lasiewski RC 1963a Oxygen consumption of torpid, resting, active, and flying hummingbirds. Physiol Zool 36: 122–40
- Lasiewski RC 1963b The energetics of migrating hummingbirds. The Condor 64: 324
- Lasiewski RC 1964 Body temperature, heart and breathing rate and evaporative water loss in hummingbirds. Physiol Zool 37: 212–23
- Maina JN 2000 What it takes to fly: the structural and functional respiratory refinements in birds and bats. J Exp Biol 203: 3045–64
- McNab BK 1966 An analysis of the body temperatures of birds. The Condor 68: 47–55
- McWhorter, Martínez del Rio C 1999 Food ingestion and water turnover in hummingbirds: how much dietary water is absorbed? J Exp Biol 202: 2851–8
- Midgley JJ, Midgley G, Bond WJ 2002 Why were dinosaurs so large? A food quality hypothesis. Evol Ecol Res 4: 1093–5
- Morrison PR 1962 Modification of body temperature by activity in Brazilian hummingbirds. The Condor 64: 315–23
- Odum EP 1945 The heart rate of small birds. Science 101(2615): 153–4
- Paul GS 1998 Terramegathermy and Cope’s rule in the land of titans. Modern Geol 23(1–4): 179–217
- Powers DR 1991 Diurnal variation in mass, metabolic rate, and respiratory quotient in Anna's and Costa's hummingbirds. Physiol Zool 64(3): 850–70
- Powers DR, Brown AR, van Hook JA 2003 Influence of normal daytime fat deposition on laboratory measurements of torpor use in territorial versus nonterritorial hummingbirds. Physiol Biochem Zool 76(3): 389–97
- Rezende EL, Swanson DL, Novoa FF, Bozinovic F 2002 Passerines versus nonpasserines: so far, no statistical differences in the scaling of avian energetics. J Exp Biol 205: 101–7
- Ruschi A 1949 Observações sobre Trochilideos. Bol Mus Biol Santa Thereza 7: 1–65
- Russell RW, Carpenter FL, Hixon MA, Paton DC 1992 The impact of variation in stopover habitat quality on migrant rufous hummingbirds. Conserv Biol 8(2): 483–90
- Sabat P, Ramirez-Otarola N, Barceló G, Salinas J, Bozinovic F 2010 Comparative basal metabolic rate among passerines and the food habit hypothesis. Comp Biochem Physiol A Mol Integr Physiol 157: 35–40
- Sander PM, Christian A, Clauss M, Fechner R, Gee CT, Griebeler E-M, Gunga H-C, Hummel J, Mallison H, Perry SF, Preuschoft H, Rauhut OWM, Remes K, Tütken T, Wings O, Witzel U 2010 Biology of the sauropod dinosaurs: the evolution of gigantism. Biol Rev 86(1): 117–55
- Schmidt-Nielsen K 1984 Chap 6: Metabolic rate and body size. 56–73 in Scaling: Why is Animal Size so Important? Cambridge, UK: Cambridge Univ Press
- Seymour RS, Smith AL, White CR, Henderson DM, Schwarz-Wings D 2011 Blood flow to long bones indicates activity metabolism in mammals, reptiles and dinosaurs. Proc R Soc B 279(1728): 451–6 [Electronic Supplementary Material]
- Suarez RK 1992 Hummingbird flight: Sustaining the highest mass-specific metabolic rates among vertebrates. Cell Mol Life Sci 48(6): 565–70
- Suarez RK 1998 Oxygen and the upper limits to animal design and performance. J Exp Biol 201: 1065–72
- Suarez RK, Gass CL 2002 Hummingbird foraging and the relation between bioenergetics and behaviour. Comp Biochem Physiol A Mol Integr Physiol 133(2): 335–43
- Suarez RK, Herrera M LG, Welch KC Jr 2011 The sugar oxidation cascade: aerial refueling in hummingbirds and nectar bats. J Exp Biol 214(2): 172–8
- Suarez RK, Welch KC Jr 2009 Stoking the brightest fires of life among vertebrates. 381–94 in Glass ML, Wood SC, eds. Cardio-Respiratory Control in Vertebrates. Berlin: Springer-Verlag
- Thompson GG, Withers PC 1997 Standard and maximal metabolic rates of goannas (Squamata: Varanidae). Physiol Zool 70: 307–23
- Weaver JC 1983 The improbable endotherm: the energetics of the sauropod dinosaur Brachiosaurus. Paleobiol 9(2): 173–82
- Wells DJ 1993 Muscle performance in hovering hummingbirds. J Exp Biol 178: 39–57
- Withers PC 1992 Comparative Animal Physiology. Fort Worth: Saunders College Publ